d
par Gérard Borvon
________________________________
Ce travail a fait l'objet de trois publications.
Dans le Bulletin de l'Union des physiciens sous le titre : "1789 dans le laboratoire de Lavoisier". n° 720. p 39-55.1989.
Dans : Les Cahiers de Beaulieu. Université de Rennes. n°23. 1997.
Dans : Histoire des sciences et des techniques. Editions du CRDP de Bretagne. p 365-379.1997.
Suite à ces publications, les fiches et la méthode ont été mises en oeuvre par plusieurs collègues qui y ont apporté leur propre créativité.
Cet article, à ranger dans la catégorie "didactique", ne doit pas effrayer le lecteur occasionnel. Il a été rédigé pour s'adresser à des enseignants, futurs ou actuels mais il devrait pouvoir aussi concerner toute personne s'intéressant à l'éducation, à l'histoire ou aux sciences. C'est du moins le souhait de l'auteur.

Une exposition au lycée de l'Elorn à Landerneau pour le bicentenaire de la mort de Lavoisier
_________________________________________________________________________________________
Lavoisier est entré dans notre classe, au lycée de l'Elorn à Landerneau, par l'intermédiaire de son Traité élémentaire de chimie publié en 1789. Un livre de cours à l'usage des chimistes débutants qui se proposait de former un chimiste en deux ans et auquel on peut encore emprunter quelques manipulations commodes.
La chimie, en classe de seconde des lycées, peut être considérée comme le passage de l'approche qualitative du collège à une approche plus quantitative. Nous allons apprendre la mole, les masses et les volumes molaires. Nous allons être capables de déterminer des proportions stœchiométriques d'une réaction et d'en déduire les quantités de produits obtenus. Lavoisier, le chimiste de la mesure, ne serait-il pas le meilleur des guides pour accompagner cette évolution ?
Nous hisser, après trois mois d'études, au niveau de la recherche "de pointe" de la fin du XVIIIe siècle, passer les résultats de Lavoisier au crible de nos connaissances actuelles, comparer son travail expérimental au nôtre, confronter son modèle de la combustion à nos représentations intuitives : voilà de quoi donner des couleurs à notre début de cours.
Début septembre on prépare le terrain par un TP.
Commencer par une séance de travaux pratiques, un "TP", est une bonne façon de prendre contact au moment d'une rentrée scolaire. C'est, dès l'abord une occasion d'entrer en possession du laboratoire et du matériel, flacons, bec Bunsen, réactifs.
Ce premier TP aura pour thème : "Combustions dans le dioxygène, celle du carbone, du soufre (sous la hotte), du fer, du magnésium". Ce TP mettant en œuvre un matériel divers annonce déjà Lavoisier et l'observation de la combustion du fer qui l'amène à formuler l'hypothèse de l'existence du dioxygène dans l'air. Il est aussi l'occasion d'accumuler des écritures de réactions chimiques qui seront rapidement utiles dans la suite du cours et dans les exercices.
Pour la combustion du fer nous utilisons de la "laine de fer", produit généralement utilisé pour l'entretien du bois des meubles. Son intérêt est une combustion vive qui se fait avec une forte incandescence mais sans émission d'étincelles.
Première manipulation : Un flacon est empli de dioxygène. Un tampon de laine de fer est placé à l'extrémité d'un crochet suspendu à une plaque de bois assez grande pour obturer le flacon. Le seul fait de passer rapidement ce tampon dans la flamme éclairante d'un bec bunsen en enflamme quelques fragments. Il faut alors le plonger rapidement mais sans heurt dans le flacon. La goutte d'oxyde magnétique obtenue après combustion adhère fortement au crochet.
Un premier sondage nous permettra d'évaluer l'image que se font les élèves de la combustion, sujet déjà étudié en collège.
Dès la fin de la manipulation chacune et chacun est invité à prendre un papier afin d'y inscrire son nom et de répondre à deux questions posées l'une après l'autre. :
1ère question : La matière qui reste fixée au crochet est-elle : moins lourde, de même masse, plus lourde, que celle du fer initial ?
2ème question : justifiez votre choix par une courte phrase (posée après la réponse à la première.
Les papiers sont ramassés sans autre commentaire immédiat. Le dépouillement effectué après le cours indiquera (chiffres de 1993 représentatifs de la répartition régulièrement observée) :
- 3 "moins lourd".
- 15 "même masse".
- 9 "plus lourd".
Les cours à venir semblent devoir être utiles !
En classe, on se sera contenté de traduire la réaction par l'équation :
Cette équation, comme celles qui l'accompagnent dans ce TP, devront être retenues par cœur (c'est du moins le souhait du professeur). Nécessaire cet apprentissage ? Ces quelques formules seront un bagage, léger mais utile, pour les étapes ultérieures. Par exemple pour illustrer un calcul de masse molaire ou pour explorer le tableau périodique.
Dans un cours sur "La mesure en chimie", nous introduisons l'ensemble des outils utiles à un élève de seconde : le nombre d'Avogadro, la mole, les masses molaires, le volume molaire et la densité des gaz.
Des exercices faisant appel aux proportions stœchiométriques deviennent alors possibles. On peut, par exemple, calculer la masse d'oxyde magnétique obtenue à partir d'une quantité donnée de fer ainsi que le volume de dioxygène nécessaire. Le moment est alors venu de faire intervenir Lavoisier.
Les fiches ci jointes, relatant la combustion du fer par Lavoisier et proposant un exercice sur ce thème sont distribuées. Une courte présentation du chimiste est faite et les élèves sont eux-mêmes invités à rassembler une documentation et à réaliser un dossier personnel le présentant dans son époque et situant sa place dans le développement de la chimie. Les fiches et le dossier seront remis au professeur quinze jours plus tard.
__________________________________________________________
__________________________________________________________
Lavoisier est véritablement le premier chimiste à avoir accordé toute son importance à la mesure en chimie. Son activité de fermier général fait de lui un homme riche qui peut utiliser revenus pour faire fabriquer les meilleurs instruments de l'époque. Son laboratoire est aujourd'hui une des pièces essentielles présentées dans le musée des Arts et Métiers à Paris.
Dans son "Traité élémentaire de chimie", il relève la difficulté pour le commerce de la diversité des étalons de mesure, en particulier ceux des masses. La livre, dit-il "diffère d'un royaume à un autre, d'une province et souvent même d'une ville à une autre".
Les chimistes, par contre, devraient pouvoir échapper à ces inconvénients dans la mesure où les réactions chimiques sont une question de proportions. Peu importe la livre choisie pourvu que les masses soient partout exprimées avec les mêmes divisions. D'où la proposition par Lavoisier d'un système décimal :
"Ces considérations m'ont fait penser qu'en attendant que les hommes, réunis en société, se soient déterminés à n'adopter qu'un seul poids et qu'une seule mesure les chimistes, de toutes les parties du monde, pourraient sans inconvénient se servir de la livre de leur pays, quelle qu'elle fût, pourvu qu'au lieu de la diviser, comme on l'a fait jusqu'ici, en fractions arbitraires, on se déterminât par une convention générale à la diviser en dixièmes, en centièmes, en millièmes, en dix-millièmes, etc. c'est-à-dire, en fractions décimales de livres".
A la fin de son traité de chimie, Lavoisier propose donc des tables de conversion entre le système de mesure français et un système décimal. Lui-même fait fabriquer des masses décimales pour ses propres balances.
Exercice : compléter les tableaux suivants.
Mesure des masses : Au 18ème siècle le système de masse, en France, comprend : la livre, le marc, l'once, le gros, le grain.
|
Unité du 18ème siècle |
Définition |
Valeur en grammes |
|
Livre Marc Once Gros grain |
1 marc=1/2 livre 1 once= 1/16 livre 1 gros=1/8 once 1 grain=1/72 gros |
489,5 g |
Mesure de longueurs : Le système comprend le pied, le pouce, la ligne, le 1/12 de ligne.
|
Unité du 18ème siècle |
définition |
Valeur en cm |
|
Pied (de roi) Pouce Ligne 1/12 de ligne |
1 pouce=1/12 pieds 1 ligne=1/12 pouce |
32,5 cm |
Volumes : Les chimistes utilisent le pouce cube (ou pouce cubique).
Convertir.
1 pouce cube = cm3
1 litre = pouce cube
Exercice : Lavoisier trouve qu'une livre d'eau a un volume de 24,687 pouces cubiques. Etes-vous d'accord ? (à rédiger sur feuille séparée)
__________________________________________________________
__________________________________________________________
Dans son traité élémentaire de chimie (1789), Lavoisier décrit une combustion de fer dans le dioxygène qui ressemble beaucoup à celle que nous réalisons au laboratoire.
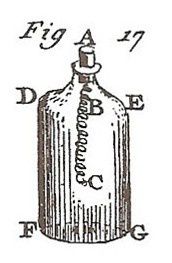
"Tout le monde connaît aujourd'hui la belle expérience de M.Ingenhouz sur la combustion du fer. On prend un bout de fil de fer très fin BC, (figure ci-contre), tourné en spirale, on fixe l'une de ses extrémités B , dans un bouchon de liège A, destiné à boucher la bouteille DEFG. On attache à l'autre extrémité de ce fil de fer, un petit morceau d'amadoue C. Les choses ainsi disposées, on emplit avec de l'air dépouillé de sa partie non respirable*, la bouteille DEFG.
On allume l'amadou C, puis on l'introduit promptement, ainsi que le fil de fer BC dans la bouteille, et on la bouche comme on le voit dans la figure que je viens de citer.
Aussitôt que l'amadoue est plongée dans l'air vital*, elle commence à brûler avec un éclat éblouissant ; elle communique l'inflammation au fer, qui brûle lui-même en répandant de brillantes étincelles, lesquelles tombent au fond de la bouteille, en globules arrondis qui deviennent noirs en se refroidissant, et qui conservent un reste de brillant métallique. Le fer ainsi brûlé, est plus cassant et plus fragile, que ne le serait le verre lui-même ; il se réduit facilement en poudre et est encore attirable à l'aimant, moins cependant qu'il ne l'était avant sa combustion."
*remarque : " l'air dépouillé de sa partie non respirable" est l'oxygène ou "air vital". A ce moment de son cours, Lavoisier n'utilise pas les mots oxygène et azote qu'il a cependant déjà définis deux ans plus tôt mais qui ne sont pas encore dans le langage courant. Il les introduira dans la suite de son livre. La "poudre d'algoroth", le "sel alembroth", le "pompholix", le "turbith minéral", sont des termes familiers aux chimistes du 18ème siècle alors que les mots oxygène ou hydrogène sont considérés comme barbares !
Pour pouvoir effectuer des mesures précises, Lavoisier élabore un montage d'une grande ingéniosité ( voir figures 3 et 11).
Le fer est placé dans une soucoupe sous une cloche contenant du dioxygène, l'ensemble étant posé sur une cuve à mercure. On peut ainsi mesurer le volume de dioxygène consommé dans la combustion et la masse de l'oxyde de fer formé. Remarquez (figure 11) l'emploi d'une loupe pour enflammer une mèche à travers le verre de la cloche.
Quand la combustion est terminée :
"On enlève doucement la cloche ; on détache de la capsule les globules de fer qui y sont contenus ; on rassemble soigneusement ceux qui pourraient s'être éclaboussés et qui nagent sur le mercure, et on pèse le tout. Ce fer est dans l'état de ce que les anciens chimistes on nommé éthiops martial ; il a une sorte de brillant métallique ; il est très cassant, très friable, et se réduit en poudre sous le marteau et sous le pilon. Lorsque l'opération a bien réussi, avec 100 grains de fer on obtient 135 à 136 grains d'éthiops. On peut donc compter sur une augmentation de poids au moins de 35 livres par quintal.
Si l'on a donné à cette expérience toute l'attention qu'elle mérite, l'air se trouve diminué d'une quantité en poids exactement égale à celle dont le fer a augmenté. Si donc on a brûlé 100 grains de fer et que l'augmentation de poids que ce métal a acquise ait été de 35 grains, la diminution du volume de l'air est assez exactement de 70 pouces cubiques à raison d'un demi grain par pouce cube. On verra dans la suite de ces Mémoires, que le poids de l'air vital est en effet, assez exactement d'un demi-grain par pouce cube."
Par la description qu'il en donne, on aura compris que le corps appelé par Lavoisier éthiops martial est ce que nous appelons oxyde magnétique auquel nous avons déjà donné la formule Fe3O4.
Relevons encore dans le texte suivant le souci de rigueur expérimentale chez Lavoisier :
"Je rappellerai ici une dernière fois que dans toutes les expériences de ce genre, on ne doit point oublier de ramener par le calcul le volume d'air au commencement et à la fin de l'expérience à celui qu'on aurait eu à 10 degrés du thermomètre, et à une pression de 28 pouces : j'entrerai dans quelques détails sur la manière de faire ces corrections, à la fin de cet ouvrage."
Aujourd'hui nous savons que le volume molaire des gaz est 22,4 l à la température de 0°C et à la pression de 760mm de mercure. On vérifiera facilement que la pression de 28 pouces est très proche de la valeur précédente. Par contre la température de 10° correspond à l'échelle Réaumur qui va du 0°R de la glace fondante au 80°R de l'eau bouillante, c'est donc une température correspondant à 12,5°C de notre échelle.
L'utilisation de la "loi des gaz parfaits" nous permettra de calculer le volume molaire des gaz dans les conditions du laboratoire de Lavoisier : 23,5 l.
Nous pouvons maintenant comparer nos connaissances avec les résultats expérimentaux de Lavoisier.
__________________________________
Exercice : (à rédiger sur feuille)
1) Quelle masse de fer exprimée en grammes représentent 100 grains de fer.
2) Quelle quantité théorique d'oxyde magnétique (exprimée en grammes puis en grains) peut-on obtenir par la combustion de ces 100 grains de fer ? Comparez à la valeur mesurée par Lavoisier.
3) Quel est le volume théorique de dioxygène (exprimé en litres puis en pouce-cubes) consommé dans cette réaction si le volume molaire des gaz est 23,5 l ? Comparez à la valeur proposée par Lavoisier.
4) Lavoiser indique que la masse (le "poids") du dioxygène ("air vital") est assez exactement d'un demi-grain par pouce-cube. Déterminez la masse volumique du dioxygène en g/cm3 puis en grain/pouce cube et comparez à la valeur proposée par Lavoisier ( le volume molaire des gaz étant 23,5 l).
__________________________________________________________
__________________________________________________________
Len résultat est généralement intéressant. La lecture du texte de Lavoisier est commode, l'étude stœchiométrique de la réaction de combustion du fer a déjà été faite en classe sous forme d'exercice d'application, le travail avec les valeurs proposées par Lavoisier est donc une forme de révision. C'est surtout une façon de comparer les calculs résultant de la théorie enseignée aux valeurs expérimentales de Lavoisier et de constater la remarquable précision de celles-ci.
Nous laisserons aux chimistes en herbe et à leurs professeurs le soin de compléter ces fiches. Pour répondre à la curiosité du lecteur pressé, disons simplement que le calcul indique une masse de 138 grains d'oxyde magnétique obtenus pour 100 grains de fer, à comparer aux 135 ou 136 grains mesurés par Lavoisier. Ce qui donne à l'expérience de Lavoisier un rendement expérimental de 98% qui mérite d'être signalé.
Plus tard, dans un autre TP dont nous reparlerons, les élèves seront eux-mêmes mis en mesure de mesurer et de comparer leurs propres résultats expérimentaux avec ceux du célèbre ancêtre.
Les dossiers remis par les élèves sont également généralement de bonne qualité. Les moyens de reprographie et de traitement de textes disponibles dans les années 90 permettent des présentations agréables en un minimum de temps. Internet n'existe pas encore dans les centres de documentation des lycées, la recherche demandait donc un travail d'investigation relativement important, pourtant, de l'avis général, ce travail était plutôt considéré comme un des bons moments du cours de chimie.
L'expérience pourrait s'arrêter là mais il est logique de poursuivre.
___________________________________________________________________________
___________________________________________________________________________
Travaux pratiques avec Lavoisier ou comment sortir d'un piège didactique.
Fin novembre, une nouvelle séquence de travaux pratiques est proposée sous le titre "Combustion du fer dans le dioxygène. Proportions stœchiométriques". La réaction a déjà été réalisée au premier TP, elle a fait l'objet de plusieurs exercices en classe, il est clairement exposé que l'intérêt de la refaire réside dans notre capacité nouvelle à en prévoir les conditions quantitatives initiales et le résultat final à partir d'un calcul.
La séance commence donc par la résolution d'un problème portant sur les conditions initiales de l'expérience :
Problème : On souhaite réaliser la combustion de 1g de fer dans le dioxygène. Quel est le volume de dioxygène nécessaire ? (on prendra 24 l pour volume molaire des gaz). Le flacon utilisé contient 650 cm3 de dioxygène. Est-ce suffisant ?
Le calcul indique un volume minimum de 286 cm3 de dioxygène, les conditions sont donc remplies et il est possible de passer à la manipulation.
Manipulation : 1 g de laine de fer est pesé, le tampon fixé au crochet est rapidement passé dans la flamme d'un bunsen et plongé dans le flacon de dioxygène. La combustion se fait sans étincelles et la boule brillante d'oxyde magnétique reste à nouveau fixée au crochet.
C'est alors que les élèves sont invités à prendre un papier et que deux questions leur sont posées.
1ère Question : La matière qui reste fixée au crochet est-elle, moins lourde, de même masse, plus lourde, que celle du fer initial ?
2ème Question (posée après la réponse à la première) : justifiez votre choix.
On aura reconnu les questions posées dès la première séance, avant même que le cours soit abordé. Cette façon d'agir était initialement destinée à vérifier les progrès des élèves, on verra par la suite que son objectif aura varié.
Les papiers sont ramassé, ils seront dépouillés par la suite. Cependant il est possible de faire un sondage oral. Nous donnerons ici encore les chiffres de l'année 1993-1994.
- Qui a répondu moins lourd ? 2 élèves (3 en septembre)
- Qui a répondu même masse ? 15 élèves ( 17 en septembre)
- Qui a répondu plus lourd ? 9 élèves (9 en septembre)
Des proportions figées à trois mois d'intervalle malgré un enseignement particulièrement répété. De quoi désespérer le professeur le mieux trempé quand, du moins, il rencontre ce résultat pour la première fois. Le professeur averti saura que le même test pratiqué plusieurs années de suite donne à chaque fois des résultats proches.
La question était donc en elle-même un "piège didactique" dans lequel professeur et élèves semblaient être tombés. Restait à en sortir honorablement et, pourquoi pas, en faire un élément d'apprentissage.
Trois réponses différentes donc dans la classe. Comment trancher ? Les balances sont à portée de main sur les paillasses et tout naturellement quelqu'un propose : et si on pesait ?
Mais la mesure n'est pas encore faite qu'une agitation gagne les rangs. Un premier qui avait pronostiqué une masse égale se ravise : "Ah oui, bien sur, je me suis trompé, on a fait l'exercice, cela doit peser plus". Avis rapidement partagé par une écrasante majorité. L'autorité de la chose enseignée vient de faire irruption dans la classe et a rapidement raison de l'intuition première pourtant solidement ancrée quelque part, dans un de ces lieux secrets du cerveau.
Pesons tout de même ! Et nous obtenons une série de mesures comprises entre 1,30g et 1,40g. La masse augmente bien !
La vérification par la pesée. Aujourd'hui, à la place du trébuchet, on trouverait des balances électroniques sur les paillasses.
Et maintenant calculons ! Un calcul rapide prévoit une masse de 1,38g d'oxyde magnétique. Certaines, ou certains, se rappellent alors que Lavoisier obtenait de 135 à 136 grains d'éthiops martial à partir de 100 grains de fer. Et chacun de comparer son travail à celui de Lavoisier, et le professeur de rappeler que celui-ci disposait des meilleurs instruments de mesure de l'époque ce que chacune et chacun est invité à aller le vérifier, à l'occasion d'un passage à Paris, en visitant le musée du Conservatoire des Arts et Métiers.
A la fin de cette séance, Lavoisier est un peu plus présent dans la classe. La conscience de l'importance de l'expérience, et surtout de la mesure, en sort renforcée. Sur un plan plus pratique, chacun a la conviction qu'il ne tombera plus dans ce piège (hélas, les professeurs ont le secret des pièges dans lesquels on tombe si facilement ! ).
J'ai retrouvé l'année suivante, en première, quelques uns et quelques unes de ces élèves. A l'occasion d'un travail sur la "chimie de la photographie" (c'était encore l'époque du noir et blanc argentique officiellement né, en 1839, avec Niepce et Daguerre), j'ai interrogé l'ensemble de la classe sur l'époque à laquelle on pouvait situer le début de la chimie. A la totale surprise de leurs camarades, ces élèves se sont rappelés Lavoisier, sa découverte du rôle de l'oxygène, sa mort sur l'échafaud en 1794. Je ne sais pas si le piège de la combustion du fer aurait encore fonctionné, mais au moins j'ai pu vérifier qu'un morceau de "culture scientifique" s'était installé pour quelque temps dans leur mémoire.
_________________________________________________
_________________________________________________
Analyse d'un piège didactique
Pour éclairer la persistance du pourcentage de réponses "justes" et "fausses" après un trimestre de cours, il est intéressant d'analyser les explications apportées par les élèves pour justifier leur choix.
Pourquoi "moins lourd" ?
C'est la réponse de 3 élèves sur 29.
Aurélien : Elle est moins grande qu'avant, une partie de la masse de fer a été brûlée par le dioxygène.
Maël : Moins lourd car le fer s'est consumé, donc sa masse a diminué par rapport à sa masse initiale.
Les mots "combustion", "brûler", "consumer", induisent presque nécessairement l'idée d'une perte de matière. L'image forte est celle du bois qui se consume en ne laissant que peu de cendres.
Il n'est d'ailleurs que de consulter un dictionnaire courant pour le vérifier. Par exemple, dans le Larousse en trois volumes (édition 1970).
"Combustion : action d'un corps qui se consume par le feu : quelques tourbes ne laissent qu'un faible résidu après la combustion"
"Consumer : v.tr. (lat.consumere, détruire peu à peu). Détruire peu à peu en réduisant à rien : la rouille consume le fer - une maison consumée par les flammes - la passion le consume - il se consume de chagrin - les bûches se consument lentement."
Nous pouvons trouver quelque excuse à nos élèves si les très sérieux auteurs du Larousse ont de la combustion l'image de la rouille "consumant" le fer.
Lavoisier, dans son introduction à la Méthode de nomenclature (1787), puis dans celle de son Traité élémentaire de chimie (1789), insistait sur la nécessaire précision du mot :
Le mot combustion fait naître une idée : celle d'une bûche qui se consume dans un foyer et qui se réduit à presque rien. Lavoisier propose de le remplacer par le terme oxygénation. Mais les mots ont la vie dure et même les professeurs de chimie continueront longtemps à parler de combustion (comme il continuent, d'ailleurs, à parler d'oxydation pour des réaction ne faisant pas intervenir l'oxygène).
Notre mise en scène aura été utile si elle fait comprendre que la combustion du chimiste n'est la combustion ordinaire et qu'il faudra surveiller ce mot à l'avenir. Nous aurons d'ailleurs d'autres occasions de signaler à nos élèves qu'il en est souvent ainsi des mots de la physique et de la chimie, il faut apprendre à les dépouiller de leurs habits de tous les jours.
Mais revenons à notre questionnaire et aux autres réponses des élèves.
réponse de 17 élèves sur 29, très majoritaire (59%).
Keltia : égale parce que la paille de fer a fondu, elle est devenue plus petite mais elle a conservé son poids.
Séverine : égale. En effet, toutes les particules se sont regroupées, cela forme une boule très compacte.
Delphine : je pense que la masse reste la même mais que c'est le volume qui change.
Ici c'est l'observation qui guide l'interprétation. Ce que l'on perçoit, c'est d'abord une fusion et chacun sait que lamasse se conserve dans une telle opération physique. C'est la réponse de 59% des élèves et elle répond à une logique. Pendant des siècles les métallurgistes ont décrit leur art comme celui de la simple fusion des minerais provoquée par le feu et facilitée par les "fondants" qu'on y ajoutait.
Pour d'autres élèves, l'interprétation est aussi guidée par un "savoir chimique mal assimilé".
Céline : La masse est égale, les proportions se conservent.
Frédéric : Egale, rien ne se perd dans une réaction chimique. Rien ne se gagne dans une réaction chimique.
La loi des proportions définies, celle dite de Lavoisier (qui ne l'a jamais énoncée), trouvent ici une curieuse application.
Passons à présent à la dernière série de réponses.
réponse de 9 élèves sur 29.
En septembre, environ un tiers des élèves a répondu "plus lourd". On pourrait se satisfaire de ce résultat si l'analyse des réponses ne révélait quelques surprises.
Stéphanie : plus lourd parce que le fer est devenu plus compact, il a durci.
Vincent : plus lourd, la limaille de fer rassemblée en boule est plus lourde que quand elle est dispersée.
Natacha : supérieure, parce que la paille de fer est légère mais lorsqu'elle a brûlé toute la paille de fer a fondu sur elle-même, elle pèse doc plus lourd.
Thomas : le fer a diminué de volume donc sa masse est supérieure.
L'interprétation est ici encore celle d'une simple fusion mais mal analysée. La confusion entre masse et densité est classique : il est difficile d'admettre que le kilogramme de plomb ne "pèse" pas plus lourd que le kilogramme de plumes.
Il nous reste cinq élèves qui ont su mobiliser les connaissances acquises au collège pour nous donner une réponse en rapport avec le modèle enseigné.
Cynthia : la masse de l'oxyde est plus grande car le fer est associé à un autre corps, le dioxygène.
Guillaume : l'oxygène s'est associé avec le fer en lui conférant ainsi sa masse ce qui donne l'oxyde magnétique.
En novembre huit élève donneront la réponse attendue. Après un trimestre de cours et un même exercice répété sous différentes formes, le taux de réponses "correctes", avant vérification expérimentale, n'est toujours que de 30%. Même si l'ultime vérification par la balance a probablement fait progresser le score final, cette constatation est propre à convaincre le professeur du fait que l'art d'enseigner est d'abord celui de savoir répéter sans avoir l'air de le faire.
Il est remarquable de constater que les résultats de ce questionnaire se confirment d'année en année. Par exemple pour trois années successives.
|
Année (en novembre) |
Moins lourd |
Masse égale |
Plus "lourd" (plus dense) |
Plus lourd (combinaison) |
|
1992 1993 1994 |
4 2 4 |
8 15 9 |
7 1 7 |
10 (34%) 8 (31%) 8 (28%) |
Il est également intéressant d'observer la stabilité des réponses avant et après enseignement : rappelons les résultats de 1993-1994.
|
Mois |
Moins lourd |
Masse égale |
Plus lourd (plus dense) |
Plus lourd (combinaison) |
|
septembre novembre |
3 2 |
17 15 |
4 1 |
5 (17%) 8 (31%) |
Si la proportion de réponse justes passe de 17% à 31%, c'est surtout la persistance d'un taux élevé d'erreurs qui saute aux yeux.
A y regarder de plus près, la lecture des phrases d'explication est une véritable révélation dans la mesure où elle indique une étonnante persistance dans les idées. Ceci particulièrement chez les élèves considérant que la masse ne varie pas.
Xavier en septembre : égale, la combustion n'allège pas le matière.
Xavier en novembre : égale, la combustion n'allège pas le fer.
Frédéric en septembre : égale. Rien ne se perd dans une réaction chimique. Rien ne se gagne dans une réaction chimique.
Frédéric en novembre : égale. Dans une réaction chimique, à une masse, rien n'est ajouté, rien n'est enlevé.
Céline, en septembre : égale parce que la paille de fer est devenue plus compacte mais sa masse n'a pas changé.
Céline, en novembre : égale parce que la paille de fer s'est condensée mais sa masse n'a pas changé.
Non seulement les idées se sont conservées mais les mots qui les expriment sont restés les mêmes. Les élèves auteurs de ces réponses sont les premiers étonnés quand on les met en face de ce constat.
Une chose est certaine : la notion de combustion n'est pas simple et il n'y a rien d'étonnant à ce que Lavoisier et les chimistes français qui partageaient ses idées aient dû mener bataille pour faire triompher leurs vues.
Nous invitons les lectrices et lecteurs intéressés à lire l'article que nous consacrons au sujet de leur combat contre la théorie du phlogistique.
_________________________________________________________
Dernier test.
Après quelques années consacrées à peaufiner et à faire varier ce dialogue entre notre classe et Lavoisier, un doute à commencé à germer dans l'esprit du professeur.
La combustion, au sens classique, c'est bien celle du charbon. Il faut un chimiste comme Lavoisier pour considérer que le fer est lui même un "combustible". Un retour aux sources ne serait-il pas nécessaire ?
Après avoir "brûlé" du fer et constaté l'augmentation de masse de l'oxyde obtenu. Après avoir nous être efforcés de corriger des intuitions "fausses", revenons à une manipulation classique.
Manipulation : Portons au rouge, dans la flamme chauffante d'un bunsen, un point d'un charbon de bois suspendu à un couvercle et plongeons celui-ci dans le dioygène contenu dans un flacon.
L'expérience avait déjà été faite dès le premier TP et le gaz carbonique obtenu testé à l'eau de chaux. L'équation de la réaction avait plusieurs fois été utilisée pour déterminer les proportions de la réaction, en particulier pour illustrer la notion de volume molaire des gaz. Il était donc logique, dans ce cas aussi, de proposer un test sous forme d'une question.
Question (répondez rapidement par écrit) : le morceau de charbon restant à la fin de la combustion est-il : plus lourd, de masse égale, moins lourd ... qu'il ne l'était au départ.
Le test est révélateur : une moitié de la classe se partage entre "moins lourd" et "même masse ou plus lourd" et il faut proposer de refaire l'expérience en pesant pour que les choses se remettent en ordre et que la grande majorité accepte l'idée que la masse a diminué car, cette fois, l'oxyde n'est plus un solide fixé au corps initial mais un gaz qui s'en est échappé.
L'expérience réalisée en pesant est d'ailleurs une excellente façon d'aborder la notion de rendement d'une réaction.
Qu'en conclure ? Qu'il faut un long cheminement avant de cerner la notion de "combustion". Qu'il faut savoir que le mot est trompeur et qu'il est essentiel de bien en préciser le sens chimique.
Et bien d'autres choses livrées à la réflexion de chaque lectrice ou lecteur.
Voir aussi : Lavoisier et le phlogistique
_________________________________________________________
Retour à la vie civile.
La combustion des déchets ménagers, opération à laquelle on à, aujourd'hui, attribué la dénomination "d'incinération", est un des grands sujets d'actualité. Dans l'esprit de la plupart de nos concitoyennes et concitoyens, pourtant passés sur les bancs de nos écoles et ayant subi nos cours de chimie, cette opération est la meilleure façon d'éliminer.
Question posée à un public intéressé par le sujet :
Question : A partir d'une tonne de déchets ménagers obtient-on : 10 kg, 100 kg, 1 tonne, deux tonnes, quatre tonnes... de produits ultimes ?
Question "piège" qui amène généralement une réponse majoritaire pour les 100 kg voire même 10 kg.
Il faut alors rappeler à nos concitoyens le bon vieux temps de leur cours de chimie et leur rappeler que leurs déchets étant essentiellement composés de matières organiques, c'est-à-dire de carbone, d'hydrogène et d'azote ils produiront de l'oxyde de carbone 3,67 fois plus lourd que le carbone initial, de la vapeur d'eau 9 fois plus lourde que l'hydrogène du départ et différents oxydes d'azote, le tout s'échappant par les cheminées dans une atmosphère devenue l'ultime poubelle (oublions les dioxines et autres produits du même genre). On peut leur rappeler aussi que le poids du mâchefer qu'il faudra ensuite gérer est supérieur à celui des métaux contenu dans leurs déchets.
En gros : en incinérant 1 tonne de déchets, ce sont bien environ quatre tonnes de nouveaux déchets qui viendront alimenter l'effet de serre ou encombrer nos "décharges".
C'est peut-être aussi pour ce rappel de notions anciennes fait à d'anciens collégiens et lycéens devenus citoyens adultes, qu'il est bon de bien décortiquer la notion de combustion dans nos cours de collège et de lycée.
____________________________________
Pour comprendre la persistance d'intuitions erronées, on peut lire :
__________________________________________________________
Documents joints :
On trouvera les premières fiches de ce travail proposées en 1986 par le lien ci dessous. On notera leur nature manuscrite correspondant à une période sans traitement de texte et sans internet. La photocopieuse elle même était d'usage limité.
__________________________________________________________








/image%2F0561035%2F20140324%2Fob_6b7b8e_003-vinci-dodecaedre-02.jpg)