
Dérèglement climatique, fonte des glaces, cyclones, sécheresses…coupable : le dioxyde de carbone.
Pourtant sans ce gaz il n’y aurait aucune trace de vie sur Terre.
Histoire du carbone et du CO2.
Un livre chez Vuibert.
feuilleter
L’auteur nous fait suivre la longue quête qui, depuis les philosophes de la Grèce antique jusqu’aux chimistes et biologistes du XVIIIe siècle, nous a appris l’importance du carbone et celle du CO2.
L’ouvrage décrit ensuite la naissance d’une chimie des essences végétales qui était déjà bien élaborée avant qu’elle ne s’applique au charbon et au pétrole.
Vient le temps de la « révolution industrielle ». La chimie en partage les succès mais aussi les excès.
Entre pénurie et pollutions, le « carbone fossile » se retrouve aujourd’hui au centre de nos préoccupations. De nombreux scientifiques tentent maintenant d’alerter l’opinion publique.
Seront-ils entendus ?
contact : gerard.borvon@wanadoo.fr
02 98 85 12 30
L’introduction :
CO2, fatal ou vital ?
« CO2 - Élixir de vie et tueur du climat » est le titre d’une exposition présentée au musée Naturama de Aarau en Suisse à la charnière des années 2012 et 2013.
Élixir… le mot est fort. Il a été emprunté à l’arabe médiéval « al iksīr » désignant la liqueur d’immortalité des alchimistes ou la pierre philosophale supposée transformer le plomb en or.
Dans une première partie nous choisirons ce côté lumineux de l’histoire.
Nous découvrirons la suite de tâtonnements, de réussites et aussi parfois d’échecs, qui a fait prendre conscience de l’existence et du rôle de cet « élixir », le dioxyde de carbone et de ce joyau minéral, le carbone.
Tueur de climat. Qui peut encore le nier ? Et qui peut refuser de voir que la dangereuse augmentation du CO2 dans l’atmosphère, loin d’être une malédiction portée par ce gaz, est le résultat de l’emballement d’un monde industriel développé qui gaspille les ressources fossiles accumulées sur la planète au cours de millions d’années et les disperse sous forme d’objets inutiles et de polluants multiples.
Élixir ou poison, amour ou désamour… Le carbone et le dioxyde de carbone sont symboliques de cette chimie aux deux visages qui sont aussi ceux de la science en général.
D’une part, une science « pour comprendre », qui enthousiasme les scientifiques comme les esprits curieux par ses extraordinaires avancées dans la connaissance des phénomènes naturels. Une science qui donne la liberté de penser le monde en dehors des dogmes et qui, en même temps, peut apporter du confort à la vie quotidienne de chacune et chacun.
De l’autre côté, une science au service d’une « croissance infinie », décrétée par un système économique qui impose ses choix techniques et politiques. Une science et une technique dont les bénéfices pour la société sont de plus en plus occultés par les nuisances sociales et environnementales qu’elles provoquent.
Qui s’intéresse à l’histoire des sciences et des techniques ne peut échapper à ce double sentiment :
 L’émerveillement devant l’ingéniosité de l’esprit humain et les constructions intellectuelles et matérielles qu’il met en oeuvre pour comprendre son environnement et améliorer son cadre de vie.
L’émerveillement devant l’ingéniosité de l’esprit humain et les constructions intellectuelles et matérielles qu’il met en oeuvre pour comprendre son environnement et améliorer son cadre de vie.
 La lucidité devant le redoutable pouvoir des sciences et des techniques entre les mains de ceux pour qui elles représentent d’abord un outil pour posséder ou dominer.
La lucidité devant le redoutable pouvoir des sciences et des techniques entre les mains de ceux pour qui elles représentent d’abord un outil pour posséder ou dominer.
À travers cette histoire du carbone et du CO2, nous n’échapperons pas à ces allers et retours.
Depuis l’Antiquité grecque jusqu’à Lavoisier nous suivrons une science dans laquelle nous serons tentés de ne reconnaître que la curiosité de l’enfance et l’enthousiasme de l’adolescence. Cette première partie nous apprendra ce que sont le carbone et le CO2 et comment ils contribuent à la vie sur cette planète.
Nous verrons ensuite une accélération extraordinaire des connaissances scientifiques et une multiplication de leurs applications techniques, au cours d’un xixe siècle qui s’achève avec les ondes électromagnétiques, les rayons X, la radioactivité, les premières automobiles, etc. Viendra ensuite le xxe siècle qui exploitera ces découvertes, pour le confort des sociétés développées, en même temps que se développeront leurs usages les plus redoutables.
Un développement qui amène à s’interroger sur la fonction des sciences dans nos sociétés. Car les scientifiques en font eux-mêmes le constat : alors qu’elle est depuis longtemps un indiscutable synonyme de progrès, à la fois pour les connaissances et pour la vie quotidienne, un désamour s’installe entre la science et la société.
C’est dans ces moments de doute qu’un retour aux sources peut faire revivre, à travers les écrits des auteurs des époques antérieures, les élans et les joies des premiers succès. Peut-être trouverons-nous également, dans ces expériences passées, des aides pour imaginer un nouvel avenir des sciences dans une société qui fonctionnerait sur d’autres bases que celles d’une croissance matérielle effrénée.
Note : nous avons choisi de scinder ce texte en cinq parties qui s’enchaînent mais qui pourraient également se lire de façon séparée.
Table des matières
CO2, fatal ou vital ?.
Première partie. D’Empédocle à Lavoisier, des quatre éléments à la naissance du carbone.
Au début étaient les quatre éléments. (voir)
Un modèle d’une grande puissance évocatrice.
Des quatre éléments aux quatre humeurs.
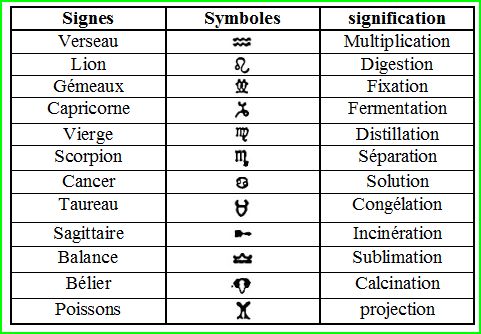
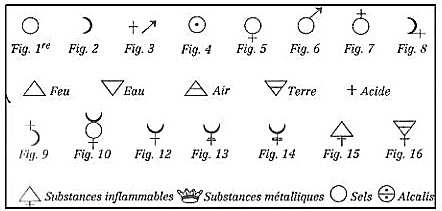
L’intermédiaire alchimique.
Jean-Baptiste Van Helmont, l’eau, la croissance des végétaux
et le « gas silvestre ». (voir)
L’alchimiste blasphémateur.
Les Anciens se sont trompés : il n’existe qu’un seul élément !.
Lavoisier et la contestation de la transmutation de l’eau en terre.
Au sujet du « gas silvestre » et de la naissance du mot « gaz ».
Hommage rendu à Van Helmont : l’adoption du mot « gaz ».
Georg Ernst Stahl, de l’élément feu jusqu’au phlogistique. (voir)
De l’alchimie à la chimie.
Du « principe sulfureux » au « principe inflammable » : le phlogistique.
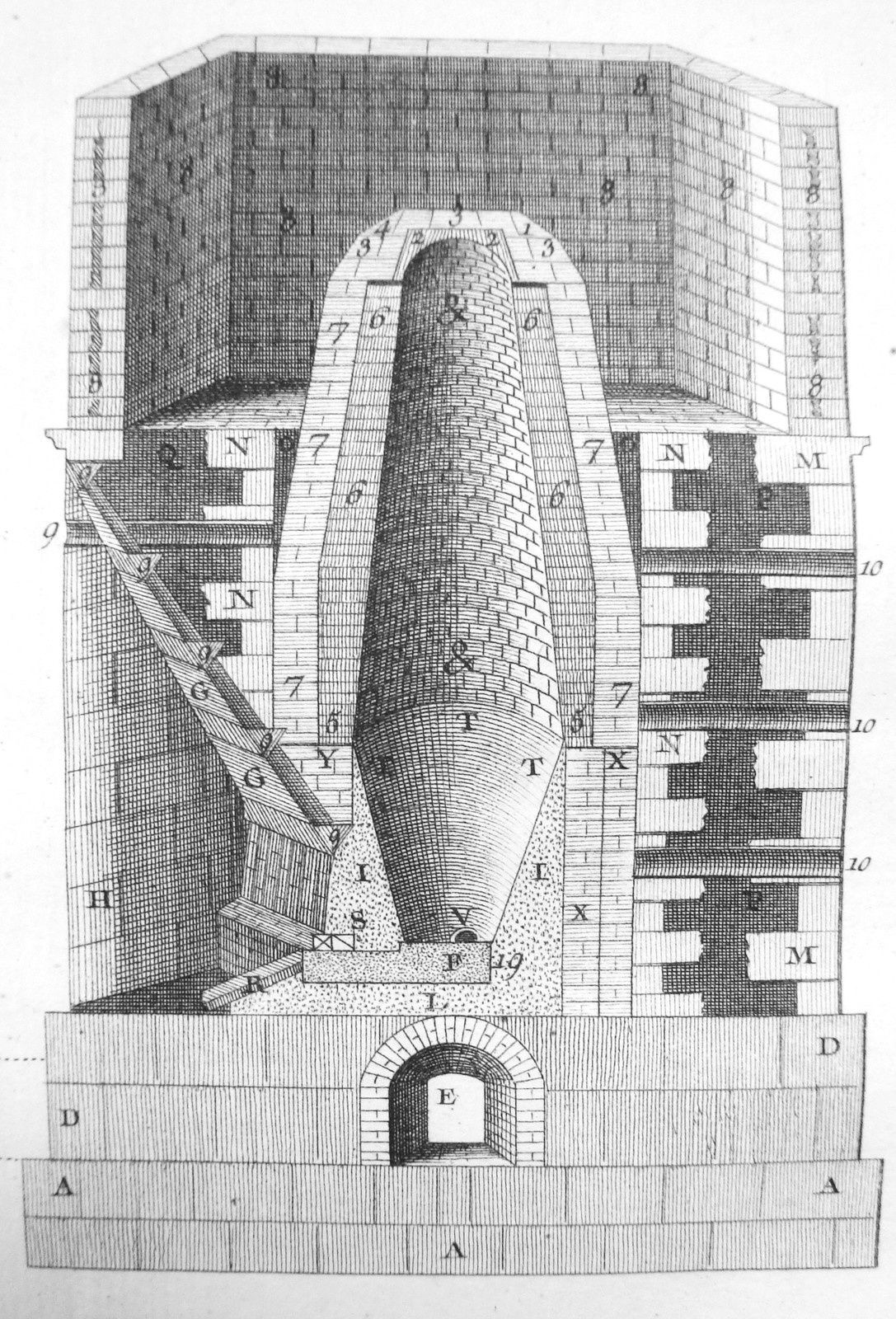
Le charbon et les métallurgistes.
Un modèle diffusé par les chimistes français.
Quand Lavoisier était encore phlogisticien.
La course aux airs.
Stephen Hales (1677-1761). Quand l’air se transforme en pierre !. (voir)
Joseph Black (1728-1799) et l’air fixe.(voir)
Henry Cavendish (1731-1810), de l’air fixe à l’air inflammable
et autres airs factices.(voir)
Joseph Priestley (1733-1804), air fixe, air nitreux, air déphlogistiqué
et autres airs.(voir)
Les plantes ne fonctionnent pas comme prévu !.(voir)
Priestley mesure l’importance de l’observation..
Priestley et l’air fixe : poison ou remède ?.
Vraiment bizarre ?.
Priestley, Scheele, Lavoisier. De l’air déphlogistiqué à l’air du feu
et à l’oxygène. . . (voir)
Priestley (1733-1804), le phlogistique et l’air déphlogistiqué.
Carl Wilhelm Scheele (1742-1786) et l’air du feu.
Lavoisier (1743-1794), de l’air vital au principe oxygine et à l’oxygène.
1774-1777 : l’air est un mélange de deux fluides.
1777 : le phlogistique n’existe pas.
Quand l’air vital devient « air acidifiant » : le principe oxygine.
Quand naît l’oxygène.
Lavoisier. De l’air fixe à l’acide crayeux aériforme
et au gaz carbonique. . . (Voir)
Quand l’air fixe devient acide crayeux aériforme..
De l’acide crayeux aériforme à l’acide charbonneux.
Quand l’acide charbonneux devient gaz acide carbonique
et quand naît le carbone.
De l’offensive anticarbone à la victoire de CO2. (voir)
Une réception « nuancée » de la part des académiciens français.
Des mots durs, barbares, qui choquent l’oreille. . . . . . . . . . . . . . . . . . .
La guerre est déclarée.
Oubliez ces carbonates, ces carbures….
Et pourtant carbone, carbonique et carbonates se sont imposés.
Symboles et équations chimiques.
O2 et CO2 : le jour et la nuit des plantes. . . (voir)
Charles Bonnet et l’alimentation des plantes par leurs feuilles. . . . . . . .
Jan Ingenhousz : le soleil rythme la vie des végétaux.
La vie nocturne des plantes.
Comme les animaux, jour et nuit, les plantes respirent.
Senebier, ou comment les plantes s’alimentent.
Lavoisier et l’apport de la chimie.
Aujourd’hui.
Et avant-hier ?.
O2, CO2 et la respiration des animaux. . . (voir)
Lavoisier et la respiration animale.
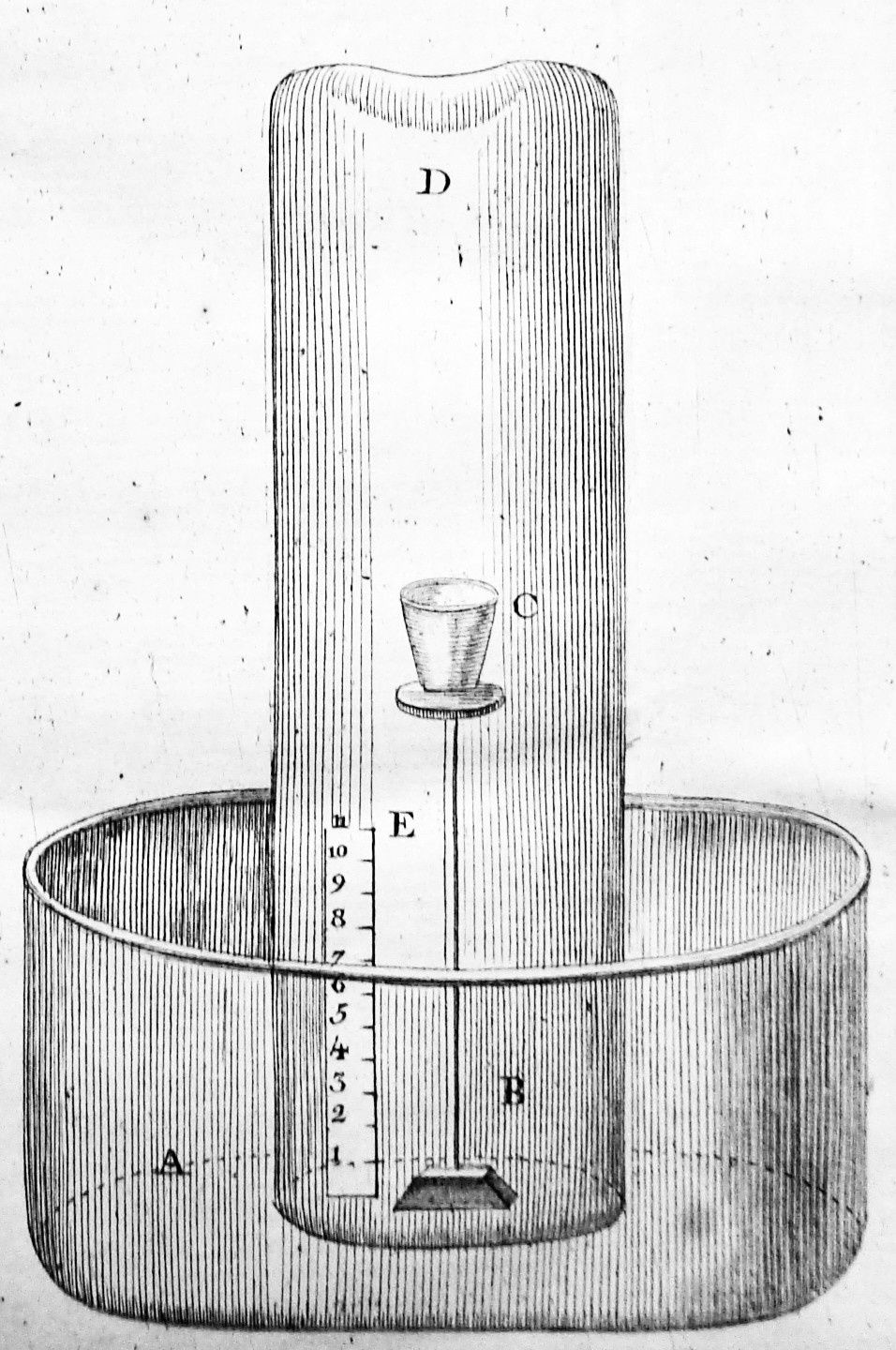
Savoir mesurer la chaleur.
Après l’unité, l’appareil de mesure. .
Les cochons d’Inde et la respiration.
Lavoisier, Seguin et la respiration humaine.
Deuxième partie. Quand la chimie était verte. . .
Quand la chimie naissait des plantes. . . (voir)
Distiller les bois, les feuilles, les graines, les racines.
Les produits précieux des résines.
Une résine élastique : le caoutchouc.
Retour aux sources.
Au sujet des charbonniers et du charbon de bois. . . (voir)
L’antiquité du charbon de bois.
L’industrie métallurgique et la grande époque des charbonniers.
Les chimistes et le charbon.
Lavoisier, le charbon et la poudre noire.
Coup d’oeil sur le charbon de bois aujourd’hui.
Mais alors, où est le problème ?.
Du bois pour les gazogènes. . .(voir)
Philippe Lebon invente le gazogène.
Gazogène à bois, le retour.
Retour aux sources ?.
Des plastiques sans houille et sans pétrole. . . (voir)
Du coton-poudre au collodion.
Du collodion au Celluloïd.
Le succès de la soie artificielle.
Et aujourd’hui ?.
Troisième partie. Quand le charbon sort de terre. . .
Le charbon et la vapeur au siècle de l’industrie. . . (voir)
Avec Denis Papin, le siècle de la vapeur commence en Angleterre.
Newcomen, Watt : de la « pompe à feu » à la machine à vapeur.
En France, de la révolution sociale à la révolution industrielle.
Le versant noir du progrès.
De la mine aux tranchées.
La colonisation, l’autre guerre.
Quand le gaz de houille éclairait la ville. . . (voir)
Les pionniers britanniques.
L’éclairage au gaz en France.
Quand les « becs de gaz » investissent le paysage urbain.
Le gaz menacé par l’électricité.
La lumière électrique à Châteaulin quand Paris l’attend encore :
beau symbole !.
Le goudron de houille et le grand oeuvre des chimistes du 19ème siècle. (voir)
Le merveilleux goudron.
L’affaire de la garance.
La conquête de l’indigo.
La suprématie allemande.
Une industrie « précieuse pendant la guerre ».
Quatrième partie. Asphalte, bitume et pétrole.
Asphalte, bitume et pétrole avant l’automobile. (voir)
Asphalte et bitume sous Louis XV.
L’asphalte dans les villes de la Belle Époque.
Le pétrole, huile de la pierre.
Quand le pétrole était un médicament.
Quel usage pour ce pétrole ?.
Le pétrole du Caucase.
Le pétrole d’Amérique.
Et en Europe ?.
Le pétrole dans le monde en 1889.
La querelle des plutoniens et des neptuniens.
Premiers pipe-lines, premiers pétroliers, premières raffineries,
premiers accidents.
Le pétrole, un produit d’avenir ?.
Et l’automobile fut. (voir)
L’automobile et la vapeur.
Quand la fée électricité animait les tramways, les fiacres et les
automobiles.
L’autre moteur.
La victoire du pétrole.
1900 : le big-bang automobile.
Le pétrole d’après.
Pour conclure.
Le carbone et la vie. (voir)
La chimie devient « organique ».
De la synthèse organique à la génétique.
Le carbone, du big-bang à l’Homo sapiens.
Naissance de la Planète bleue.
Quand s’assemblent les molécules du vivant.
La science face au désamour. (voir)
Un débat à la Sorbonne.
Débattre de la science et de la vie il y a cent ans ?.
Débattre il y a cinquante ans ?.
Lanceurs d’alerte.
Retour à la Sorbonne.
Un problème de démocratie.
Cultiver les sciences.
Rapide plaidoyer pour l’histoire des sciences.
Les sciences, remède à la technocratie ?.
Bibliographie.
Index des noms propres.
_______________________________________________________________________




/image%2F0561035%2F20230905%2Fob_d1be53_orobouros.jpg)










/image%2F0561035%2F20231210%2Fob_982f66_priestley-air-dephlogistiqe-02.JPG)
/image%2F0561035%2F20231210%2Fob_7adf52_priestley-air-dephlogistiqe-03.JPG)









/image%2F0561035%2F20140324%2Fob_6b7b8e_003-vinci-dodecaedre-02.jpg)